코오롱생명과학, 美 FDA서 ‘인보사’ 임상3상 자료 보완 요청…“임상중지는 계속”
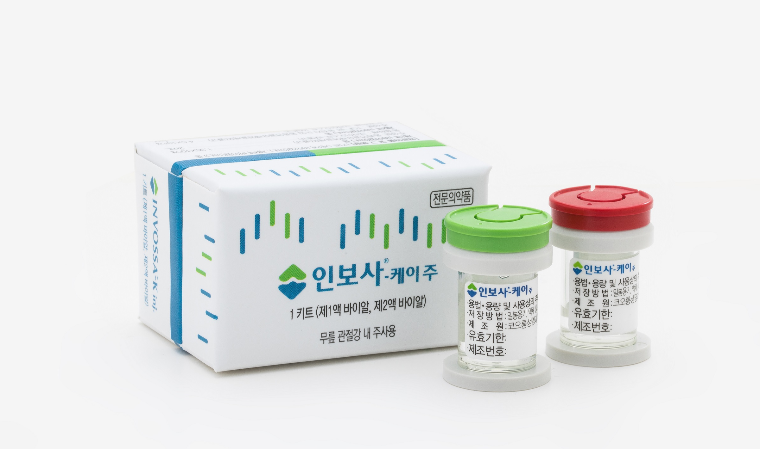
코오롱생명과학은 코오롱티슈진이 미국 FDA(식품의약국)로부터 골관절염 치료제 ‘인보사케이주’에 대해 임상 중단(Clinical Hold) 상태를 유지한다는 공문을 받았다고 23일 공시했다.
이는 지난달 23일 코오롱티슈진이 제출한 자료를 FDA가 검토한 후 나온 조치다. 미 FDA는 공문에서 임상 중단을 해제하려면 임상시험용 의약품 구성 성분에 대한 특성 분석 자료를 추가 제출하라고 요구했다. 코오롱티슈진이 보완자료 제출을 마무리하면 FDA 는 30일간의 검토 기간 후 회신을 줄 예정이다.
이번 보완 자료 세부사항에는 △인보사 제 1액 연골세포(HC)의 특성 분석 자료 보완 △제 2액 형질전환세포(TC)의 gag·pol 유전자 염기서열 분석 △방사선 조사 전·후의 제 2액 형질전환세포(TC)에 외피 유전자를 각각 도입한 레트로바이러스 생성 여부에 대한 확인 자료 등이 있다. FDA는 임상 3상 재개와는 무관한 사항으로 가장 좋은 유익성·위해성 제품 프로파일을 얻으려면 인보사 제 1액의 연골세포(HC)로 제 2액의 형질전환세포(TC)를 재제조하는 것을 권장했다. 장기 추적 프로토콜 수정사항에 대해서는 코오롱티슈진의 원안대로 유지할 것을 권장했다.
코오롱생명과학은 향후 일정에 대해 “코오롱티슈진은 미국 FDA가후 요청한 자료를 제출하고, 필요 시 대면 미팅 등을 신청하여 미국 FDA와 추가적으로 협의 할 예정”이라며 “공시사항이 발생할 경우 지체 없이 공시할 것”이라고 밝혔다.
한편 인보사는 2017년 국내 첫 유전자 치료제로 식품의약품안전처의 허가를 받았다. 하지만 주성분 중 하나가 허가사항에 기재된 연골세포가 아닌 종양을 유발할 가능성이 있는 신장세포라는 사실이 드러나 국내에서 품목허가가 취소됐고 미국에서는 진행 중이던 임상 3상이 중단됐다.
/배요한기자 byh@sedaily.com
[ⓒ 서울경제TV(www.sentv.co.kr), 무단 전재 및 재배포 금지]
관련뉴스
- 국내 주식형 펀드 수익률 81.5%…국내가 해외 압도
- 이찬진 금감원장 "소비자 보호 최우선…주가조작 무관용·생산적 금융 촉진"
- 이억원 금융위원장 "금융 대전환 가속…생산적·포용적·신뢰금융 3대 축"
- 강태영 농협은행장 "초개인화·생산적 금융·Agentic AI로 전략 전환"
- 김인 새마을금고중앙회장 "리스크 관리가 곧 조직 생존"
- 이창용 “고환율 기대 관리…연초 외환시장 경계”
- 병오년 증시 ‘활짝’…새해 첫날 쌍끌이 랠리
- "디지털 자산·AI 시장 선점... 4대금융 '대전환' 선언
- 박상진 산업은행 회장 "올해가 국가 경제·산은 성장 골든타임"
- 양종희 KB금융 회장 "전환과 확장 통해 미래 성장 기반 구축"
주요뉴스
기획/취재
주간 TOP뉴스
- 1국가검진 개편…"폐기능검사 도입하고 출장검진 깐깐하게"
- 2中업체에 1위 내준 테슬라, 작년 전기차 인도 8.6%감소한 164만대
- 3李대통령 "저 역시 '하나의 중국' 존중…韓中 정상 매년 만나야"
- 4KT 위약금 해지 사흘 3만명 이동…70% SKT로 몰렸다
- 5국내 주식형 펀드 수익률 81.5%…국내가 해외 압도
- 6세계 32개 은행, 소액 즉시 해외송금 추진…"핀테크 대응"
- 7올해 10대 그룹 신년사 최다 언급 키워드는 'AI·고객·변화'
- 8주유소 기름값 4주 연속 하락…"다음 주도 하락 전망"
- 9김천교육지원청, 새해 충혼탑 참배 및 새해다짐식 개최
- 10포항시의회, 2026년 신년인사회 개최
































댓글
(0)