젬백스, 'GV1001' 알츠하이머병 치료제…임상 3상 식약처 승인
증권·금융
입력 2022-01-17 08:09:44
수정 2022-01-17 08:09:44
배요한 기자
0개

[ⓒ 서울경제TV(www.sentv.co.kr), 무단 전재 및 재배포 금지]
관련뉴스
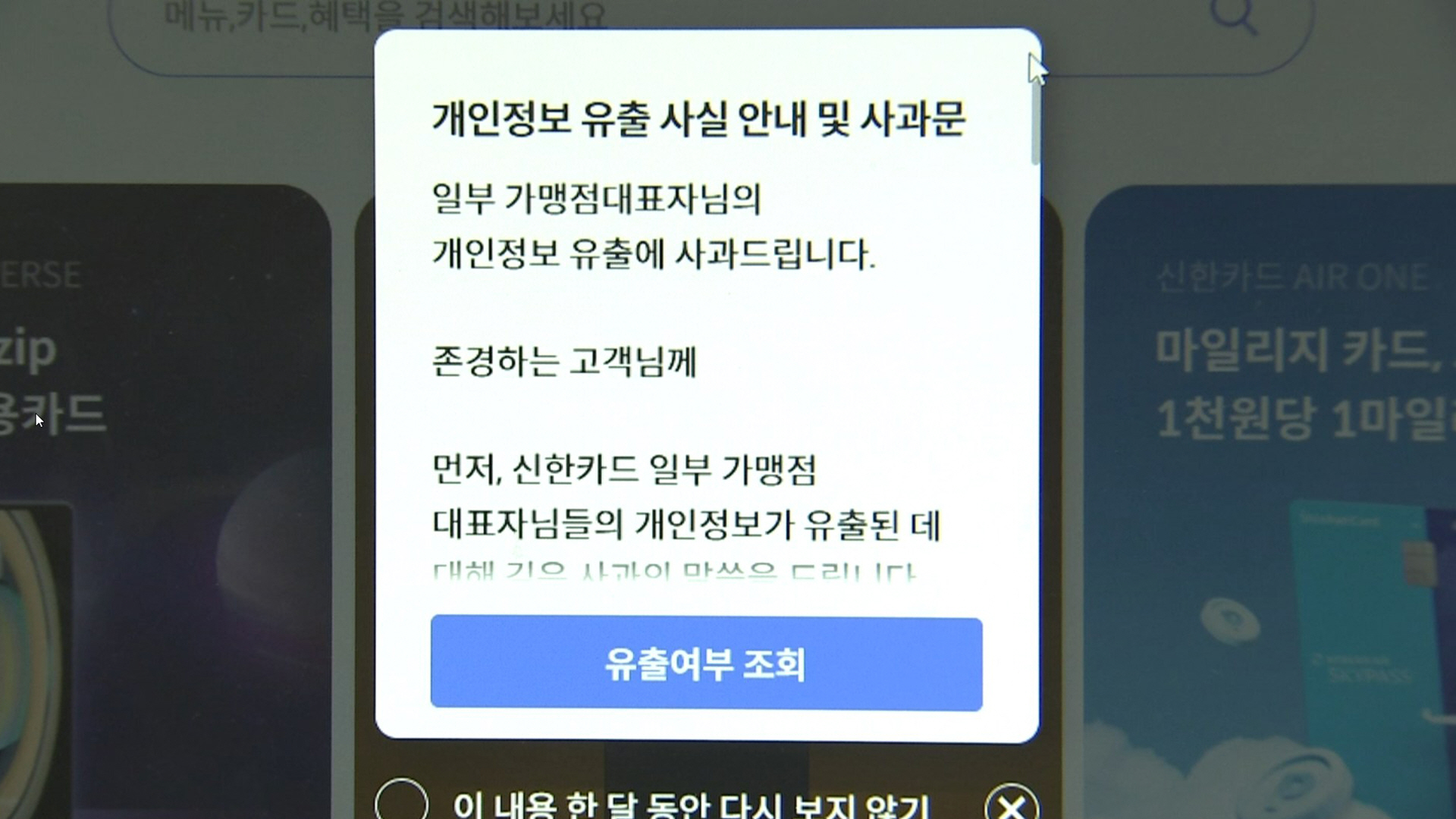
- 신한카드 내부통제 허점…금융위 "전 카드업권 점검"
- 하나금융, 전략 축 바꿨다…'대출'에서 '투자 금융'으로
- 내년부터 상폐 요건 강화…퇴출 기업 늘어날까
- 금감원 신임 부원장에 김성욱·황선오·박지선
- 코빗, 루트스탁(RIF) 에어드랍 이벤트 실시
- KB라이프-서울대, 'KB골든라이프 시니어 컨설턴트 양성과정' 신설
- NHN KCP, 주당 250원 현금배당 결정…"주주환원 정책 강화"
- 애큐온저축銀, 임직원 참여형 '2025 사내 강사 교육' 성료
- 빗썸, 사회공헌 브랜드 '빗썸나눔' 공식 홈페이지 개설
- 카카오페이, 금융 익힘책 '오늘의 금융' 출간
주요뉴스
기획/취재
주간 TOP뉴스
- 1남원 관광 1105만 명 시대…'체류형 관광도시' 전환 본격화
- 2광해광업공단, 지역 입소보호시설 아동·장애인에 ‘이불세트’ 지원
- 3원주시 물 공급 문제 해결 촉구…곽문근 부의장, 김성환 장관 면담
- 4강원랜드, 성탄절 맞아 신규 일식당 ‘린카’ 오픈… 비카지노·체류형 관광 강화
- 5남원시, 2025 문화예술 결산…'문화성장도시' 입지 굳혀
- 6시흥시, ‘환경도시’ 전략 추진
- 7시몬스 테라스 ‘크리스마스 트리·일루미네이션’… 이천 겨울 상권에 활기
- 8전북대 남원글로컬캠퍼스에 휴식형 '도시숲' 확장
- 9이숙자 남원시의원, 대한민국 지방자치평가 우수의원 영예
- 10담양 산성산 도시숲, 치유·회복의 숲으로 새 단장






































댓글
(0)